近日,我校袁泽利教授团队在国际药物化学顶刊《Journal of Medicinal Chemistry》(IF=6.8,中科院1区TOP期刊)发表题为“A Nitroreductase-Activated Chemiluminescent Prodrug for Real-Time Monitoring of Camptothecin Release in Peritoneal Metastasis Theranostics”的最新研究成果。2022级药剂学硕士研究生韦恋祝为该论文第一作者,通讯作者为袁泽利教授和高杰副教授,共同通讯为北京化工大学耿文超副教授,遵义医科大学为论文第一单位。
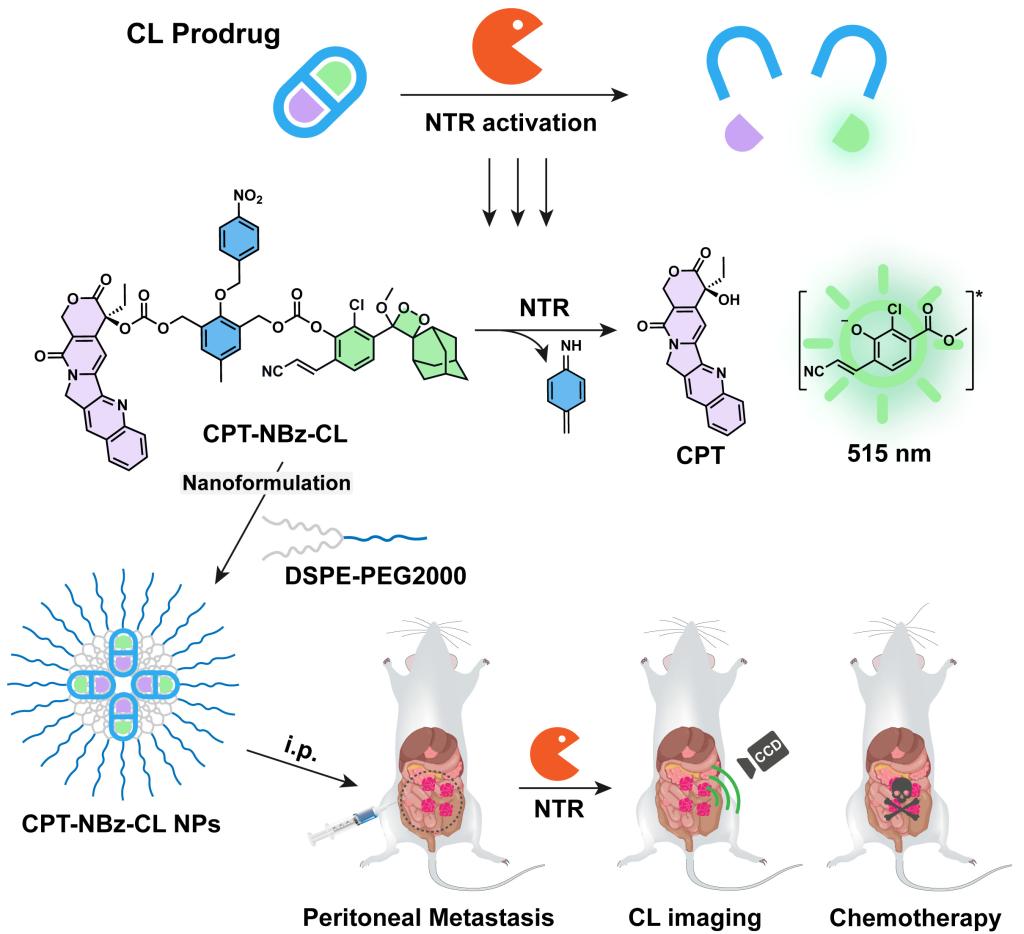
精确控制药物在体内的时空活性是化疗领域的重大挑战,传统化疗药物常因缺乏靶向性而导致全身毒副作用。前药策略是通过对化疗药物进行化学修饰,使其在特定生理刺激下激活,实现靶向治疗。然而,如何实时、可靠地监测前药在体内的激活和释放过程,是充分发挥其临床潜力的关键。
该研究通过精巧的分子设计,构建了一种新型硝基还原酶(NTR)激活的化学发光前药CPT-NBz-CL,巧妙地将抗癌药物喜树碱(CPT)、缺氧响应基团4-硝基苄基(NBz)和化学发光报告基团通过自催化裂解连接子整合为单一分子实体。该前药在常氧条件下保持稳定,细胞毒性被有效屏蔽;而在缺氧的肿瘤微环境中,高表达的NTR催化NBz基团还原,触发自催化裂解反应,同时释放活性药物CPT并产生强烈的化学发光信号,实现了“药物释放-信号产生”的精确同步。为克服前药水溶性差的问题,研究团队进一步将其制备成纳米制剂(CPT-NBz-CL NPs),显著改善了生物相容性和体内递送效果。体外实验证明,该纳米制剂具有显著的缺氧选择性细胞毒性,并能在缺氧环境下发出化学发光。在腹膜转移瘤小鼠模型中,CPT-NBz-CL NPs通过体内化学发光成像,成功描绘出缺氧肿瘤区域。更重要的是,其抗肿瘤效果与游离CPT相当,但显著降低了原药的全身毒性。该策略为腹膜转移等恶性肿瘤的精准诊疗提供了新的解决方案。
该研究首次建立了基于NTR激活的化学发光诊疗平台,不仅拓展了化学发光技术在肿瘤诊疗中的应用范围,更为缺氧肿瘤的靶向治疗提供了创新思路。相比于传统荧光成像,化学发光技术具有背景信号低、穿透深度大等优势,在深部组织成像方面展现出独特价值。该成果对推动新一代智能诊疗药物的研发和临床转化具有重要意义。
该研究成果得到了国家自然科学基金、贵州省科技厅、遵义市科技计划等项目经费支持。(一审:高杰,二审:高健美,三审:袁泽利;图文:贵州省医用光学诊疗技术研究国际科技合作基地)
论文链接:https://doi.org/10.1021/acs.jmedchem.5c01674

